青蒿素与牛病毒性腹泻病毒NS5B蛋白的分子对接预测及其抗病毒作用
时间:2023-11-04 16:15:02 来源:小苹果范文网 本文已影响 人 
邵百卉,姜东君,谢艺萌,刘思雨,邵子益,张泽财,2,计 红,朱战波,2
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;
2.黑龙江省牛病防控工程技术研究中心,大庆 163319;
3.济宁医学院精神卫生学院,山东省行为医学重点实验室,济宁 272067)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)为黄病毒科瘟病毒属的成员之一,是单链正股的RNA病毒。BVDV在世界范围内广泛分布,并造成严重的经济损失[1]。BVDV感染可引起牛的多种疾病,包括呼吸道、消化道和生殖系统疾病,母牛妊娠50~150 d感染BVDV产出的持续性感染牛(PI牛)被认为是该病最重要的传染源[2]。BVDV基因组长度为12.3~12.5 kb,含有1个由5′-和3′-非翻译区(UTRs)组成的大开放阅读框(ORF)。编码最终蛋白产物为结构蛋白C、Erns、E1、E2和非结构蛋白Npro、P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B组成[3]。NS5B位于多蛋白的羧基末端,在瘟病毒中高度保守,并被证实具有RNA依赖的RNA聚合酶(RdRp)活性,主要负责病毒基因组的转录和复制。由此,可能成为开发抗BVDV药物的理想靶标[4]。20世纪60年代,在欧洲某些国家的奶牛和肉牛中该病毒的检出率为53%~73%,而发展到20世纪90年代后,BVDV的检出率居然高达90%以上。近年来在国内BVDV的阳性检出率逐年上升[5]。为了使BVDV的感染在全世界得到有效控制,国内外很多学者对该病毒做了全面深入的研究,但仍然没有有效的疫苗或可选择的抗病毒药物[6],因此,进行天然药物成分抗病毒作用的研究显得尤为重要[7-8]。
青蒿素是从植物黄花的蒿茎叶中提取出的含过氧基团的倍半萜内酯类天然小分子,同时也是高效低毒的抗疟药之一[9]。青蒿素具有广泛的生物活性,已在疟疾治疗中取得世界瞩目的成果,近期研究也表明青蒿素在对抗病毒感染诱导的炎症反应和某些癌症的治疗方面具有潜在的生物活性[10]。目前,已有很多中药应用于抗病毒中,如松花粉多糖可有效抑制病毒的黏附,还能显著降低免疫器官的病毒载量,改善免疫抑制,板蓝根作用于病毒的黏附和复制过程,能在一定程度上减轻炎症反应,黄芪多糖,槐树多糖和川明参多糖等均可以通过促进细胞因子的分泌,激活免疫通路、增强免疫系统功能来发挥抗病毒作用[11];
冰香散在最低无毒浓度下即可表现出预防和直接抑制体外流感病毒复制的作用[12]。就目前研究来看,青蒿素对黄病毒科中BVDV和丙型肝炎病毒具有抗病毒效果,但有关抗病毒机制方面的研究鲜见报道。本研究拟采用分子对接的方法预测青蒿素与BVDV NS5B的相互作用,在初步预测的基础上,应用MDBK细胞确定青蒿素对BVDV体外复制的影响,为进一步研究青蒿素的抗病毒活性及其抗病毒机制提供理论依据。
1.1 材料
1.1.1 细胞及毒株 MDBK(CCL-22)细胞和NADL株BVDV(CP型)均由黑龙江八一农垦大学牛病防治工程技术中心实验室保存。
1.1.2 主要试剂 青蒿素提取物购于成都曼斯特生物公司,纯度>98%,药品均配制成浓度为200 μmol/L的储备液,4 ℃保存,使用时用无血清的DMEM培养基稀释成所需浓度。DMEM培养液和胎牛血清均购于四季青试剂公司;
CCK-8细胞活性检测试剂盒购于上海碧云天生物技术有限公司;
逆转录试剂盒、SYBR荧光定量RT-PCR试剂盒购于TaKaRa公司。
1.2 方法
1.2.1 结构预处理 青蒿素结构(MOL007424)源自TCMSP数据库(http:∥lsp.Nwuedu.cn/tcmsp.Php),通过PyMOL软件转换成PDB结构;
BVDV-NS5B受体蛋白(PDBID:1S48)源自蛋白质数据库(http:∥www.Rcsb.org/pdb),下载得到FASTA Sequence结构,通过SWISS-MODEL进行同源建模(https:∥swissmodel.expasy.org/),获得并下载该蛋白,转换成PDB晶体结构。模拟对接前蛋白分子和药物小分子均通过Autodock Tools1.5.6进行加氢、减电荷及非极性氢键结合处理,保存成PDBQT文件。
1.2.2 Autodock分子对接 将处理完毕的配体分子(青蒿素)和受体分子(BVDV-NS5B)用Autodock软件进行分子对接,设置格点间隔值。设置Grid参数,x为118,y为108,z为90,运行程序进行对接。用Autodock软件分析生成对接的.dlg文件,根据结合能等情况选择结合能最低的结合构象并保存成.PDBQT文件。通过PyMOL软件对其分子构象进行Cartoon展示并生成图片。
1.2.3 青蒿素对细胞毒性的测定 采用CCK-8试剂盒对不同浓度青蒿素作用于MDBK细胞后的细胞毒性进行测定。将生长状态良好的MDBK细胞按照每孔100 μL(1×105/mL)接种到96孔细胞培养板,待细胞长到汇合度为80%时,弃掉营养液并用PBS洗涤3次。随后,用DMEM培养液把青蒿素储备液(200 μmol/L)稀释为11个不同浓度:0(对照组)、2.5、5、10、20、40、60、80、100、150、200 μmol/L,每个浓度设4个重复孔,每孔加入100 μL药物稀释液,并设置4个空白对照孔(不加细胞和药物,只有培养液)。置于37 ℃、5% CO2培养箱中培养,72 h后,每孔加入10 μL的CCK-8溶液,培养2 h后,用酶标仪测定450 nm处的吸光度(D)值。
依据公式:细胞存活率(%)=(D450 nm药物组-D450 nm空白对照组)/(D450 nm细胞对照组-D450 nm空白对照组)×100%,计算MDBK细胞在不同浓度下青蒿素的细胞存活率。
1.2.4 青蒿素体外抗BVDV活性试验 MDBK细胞处理同1.2.3。根据青蒿素对MDBK细胞毒性的检测结果,用细胞维持液以青蒿素最适浓度为基准进行2倍梯度稀释,依次稀释成5个浓度备用;
各试验组使用感染复数(MOI)为0.1的剂量接种BVDV病毒液,同时设置正常细胞对照组、病毒对照组(0 μmol/L青蒿素)、空白对照组,每组均做4个重复孔。根据药物与病毒添加的先后顺序探究药物抑制作用、预防作用和杀灭作用。其中药物抑制试验是在各试验组每孔先接种上述剂量的BVDV 2 h后弃去,再加入200 μL不同浓度的药物;
药物预防试验是在各试验组每孔加入200 μL不同浓度的药物作用4 h后弃去,再接种上述剂量的BVDV作用2 h后弃去,再在每孔加入200 μL不同浓度的药物;
药物杀灭作用是在各试验组每孔中同时添加不同浓度的药物溶液与等体积病毒液的混合液200 μL,作用4 h后弃去,每孔再加入200 μL不同浓度的药物。放置培养箱作用并逐日观察病变,待出现明显病变时向各孔中加入20 μL的CCK-8溶液,随后置于37 ℃、5% CO2培养箱中作用2 h,用酶标仪进行细胞活性的检测,按照1.2.3中方法计算各组的细胞存活率。
1.2.5 药物对 BVDV复制的影响 确定了3种不同方式下青蒿素抗BVDV的最佳浓度后,按照药物体外抑制BVDV、药物体外预防BVDV和药物体外杀灭BVDV 3种作用方式开展试验,每孔加入MOI为0.1的BVDV病毒液,并设置病毒对照组。在48 h以及72 h时提取各组总RNA,通过逆转录反应合成cDNA,作为模板,进行SYBR Green 法荧光定量技术检验。BVDV引物序列为:F:5′-GAGT-ACAGGGTAGTCGTCAG-3′;R:5′-CTCTGCAG-CACCCTATCAGG-3′(引物为黑龙江八一农垦大学牛病防治工程技术中心实验室保存)。预期扩增长度为130 bp。PCR反应条件:95 ℃ 30 s;
95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环,根据标准曲线计算出其病毒载量。
1.2.6 数据统计分析 数据采用SPSS 25.0统计学软件处理。试验结果以平均值±标准差表示,组间两两比较采用独立样本t检验,P>0.05表示差异不显著;
P<0.05表示差异显著;
P<0.01表示差异极显著。
2.1 青蒿素与BVDV-NS5B对接分析结果
结果表明,通过蛋白质数据库收集到的BVDV-NS5B受体蛋白(PDBID:1S48)存在潜在作用靶点,通过TCMSP数据库收集到青蒿素的配体结构,进行分子对接找到药物与BVDV NS5B蛋白结合的“分子口袋”。经过模拟筛选以及Autodock软件进行运算分析,最终得到10个分子和对应的打分(表1)。结果表明,青蒿素位点1与BVDV-NS5B结合后的结构最稳定,结合自由能为-28.6748 kJ/mol。图1为青蒿素位点1与BVDV-NS5B的结合图,提示青蒿素可能具有抑制BVDV活性的功能。
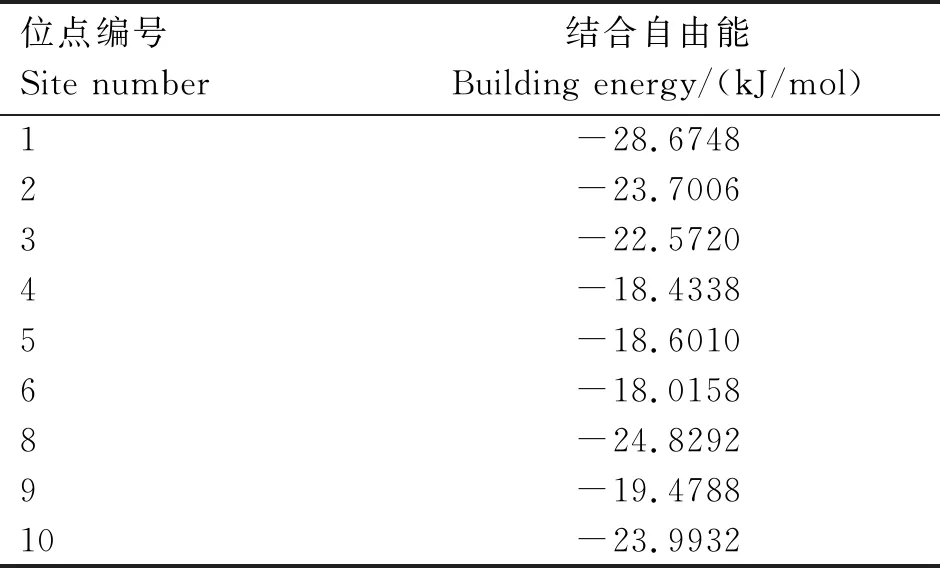
表1 青蒿素与BVDV-NS5B不同对接位点的结合能

图1 青蒿素与BVDV-NS5B结合图
2.2 青蒿素对细胞的毒性试验
由图2可知,作用72 h后,与0 μmol/L青蒿素处理(对照组)相比,2.5、5、10、20、40、60、80 μmol/L青蒿素处理组MDBK细胞存活率均极显著提高(P<0.01),而100、150、200 μmol/L青蒿素处理后的细胞存活率与0 μmol/L 青蒿素处理后的存活率变化幅度相对较小。最大安全浓度应选择浓度低且对细胞活性影响较小的浓度,故选定100 μmol/L青蒿素为最大安全浓度。

与对照组相比,*,差异显著(P<0.05);**,差异极显著(P<0.01)。下同
2.3 青蒿素抗BVDV效果
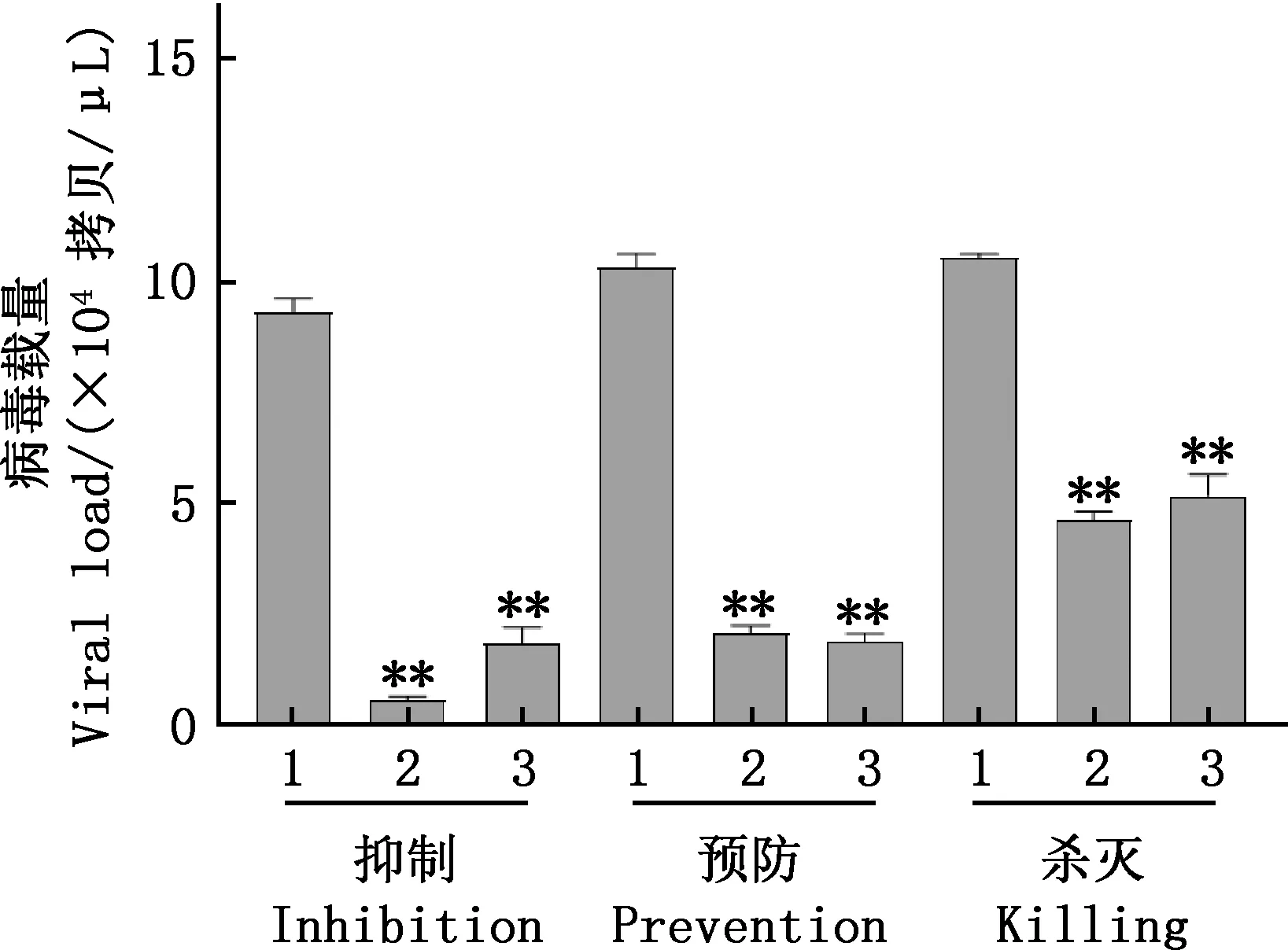
2.3.1 青蒿素对BVDV的抑制作用 在上述试验基础上,将青蒿素依次稀释为100、50、25、12.5、6.25 μmol/L进行后续试验。在先加病毒再加药的给药方式下,细胞观察结果显示,试验组与病毒对照组相比,细胞病变的程度均有所减轻。由图3A可知,青蒿素添加浓度为100、50、25、12.5 μmol/L时MDBK细胞存活率均在50%以上,且极显著高于病毒对照组(P<0.01),其中浓度为100 μmol/L时抑制作用最为显著,细胞存活率高达71%,表明该作用方式下青蒿素对BVDV有较强抑制作用。
2.3.2 青蒿素对BVDV的预防作用 在先加药再加病毒的给药方式下,观察发现,试验组与病毒对照组相比,细胞病变的程度均有所减轻。由图3B可知,与病毒对照组相比,5个浓度水平的青蒿素均能极显著提高MDBK细胞的存活率(P<0.01),其中青蒿素浓度为100 μmol/L时,预防作用最为显著,细胞存活率达到了68%。
2.3.3 青蒿素对BVDV的杀灭作用 由图3C可知,在药物与病毒同时作用的给药方式下,各加药组的细胞存活率较病毒对照组均极显著提高(P<0.01)。5种不同浓度的青蒿素对BVDV均表现出有一定的杀灭作用,且在安全浓度范围内,呈一定的量效关系。相比青蒿素的其他浓度组,100 μmol/L浓度组MDBK细胞的存活率最高(58%)。

A,抑制作用;
B,预防作用;
C,杀灭作用
综合3种作用方式,均在青蒿素浓度为100 μmol/L时抗BVDV效果最为显著,所以青蒿素对BVDV的最佳作用浓度为100 μmol/L。
2.4 青蒿素对 BVDV 复制的影响
在3种作用方式检测青蒿素作用于MDBK细胞后BVDV的复制水平,如图4所示,当先加病毒后加药物时,同病毒对照组相比,48 h抑制组与72 h抑制组均可极显著降低BVDV在细胞中的表达量(P<0.01),同72 h抑制组相比,48 h抑制组的抑制作用更为显著。先加药物后加病毒时(预防作用),与病毒对照组相比,48与72 h预防组均能极显著降低病毒表达量(P<0.01),其中72 h的药物预防作用更为显著。当药物与病毒1∶1同时加入时,同病毒对照组相比,48与72 h杀灭组均可极显著减少病毒在细胞中的复制(P<0.01),但同预防组与抑制组相比,对BVDV复制效果影响相对较小。综合3种方式,后给药物体外培养48 h时青蒿素对BVDV复制的抑制作用更明显,可大幅度降低BVDV拷贝数。
1,病毒对照组;
2,48 h;
3,72 h
在临床应用中,对于病毒性疾病的治疗药物筛选一直存在技术瓶颈,抗病毒特效药物缺乏且存在不良反应,中草药因其独特的作用机制,不易产生耐药性且毒副作用小而受到广泛的关注。目前,牛病毒性腹泻的防控仍然是全球养牛业的难题,临床上亟需能有效抑制BVDV的药物。在新药研发过程中,应用虚拟筛选可以富集活性化合物,降低筛选成本,提高药物筛选的可行性,因此已成为新药研发的重要方法。自20世纪70年代中期首次出现以来,分子对接已经成为一种独特的辅助药物设计和发现的计算机工具[13]。据报道,青蒿素对于RNA病毒具有不同程度的抗病毒效果,对部分黄病毒有良好的抑制作用[9],但是对于BVDV,目前鲜见相关研究报道,其中药物的抗病毒机制也不够明晰。本研究探索了青蒿素对黄病毒科中BVDV的抗病毒效果。分子对接结果显示,青蒿素与BVDV-NS5B蛋白存在相互作用,青蒿素中的10个活性位点均可与BVDV NS5B有机结合,通过打分结果可找到小分子配体与生物靶标大分子结合的最优构象,预测出2个分子之间最佳的结合模式,最后将最佳配体进行实体药物筛选,可能筛选出具有活性的先导化合物。青蒿素活性位点1与BVDV-NS5B结合时的自由能为-28.6748 kJ/mol,结合的自由能较低,推测构象稳定,与受体结合的亲和力强,对蛋白质受体可能具有抑制活性,需要进一步验证。
筛选药物的方法主要有体外试验和体内试验,中药的成分极其复杂,干扰体内试验的因素较复杂,故很难深入清楚了解药物作用的本质以及导致各种变化的细节、规律,而体外试验可以了解药物的作用规律并分析细节,可重复性高。目前,CCK-8试剂盒是MTT比色法的升级替代品,比MTT更加稳定,对细胞毒性极小,测试结果更加稳定,更加敏感[14-15]。因此采用CCK-8试剂盒进行细胞毒性试验和抗病毒药效学试验,可更客观地评价药物的抗病毒作用[15]。不同浓度的青蒿素处理MDBK细胞后均维持了较高的细胞存活率,说明青蒿素药物本身对MDBK细胞无毒性,部分浓度甚至可以促进细胞生长,但为了减少药物对细胞生长率的影响以及节约成本,故选取对MDBK细胞影响较小且较低的浓度进行后续试验。青蒿素在体外对BVDV复制的影响结果表明,青蒿素对MDBK细胞的最大安全浓度为100 μmol/L,进一步发现3种作用方式下青蒿素对BVDV均有抑制作用,研究采用SYBR Green 法荧光定量技术检测了BVDV在细胞中的水平,结果提示3种作用方式中药物抑制组效果最佳,对病毒复制有极显著的抑制作用,推测其抗病毒的主要效应可能是青蒿素进入细胞内抑制了BVDV的复制或直接杀灭游离的BVDV而发挥作用,其确切的作用机理有待进一步的深入研究。
中国的传统中医药有着很长的发展历史,在抗病毒研究领域中已取得很大进展[16]。已有研究发现,诃子提取物对1型艾滋病病毒 (HIV-1)具有抑制作用[17],甘青乌头提取物可抑制单纯疱疹病毒Ⅱ型(HSV-2)病毒[18],二萜生物碱可明显抑制甲型H1N1流感病毒 (H1N1)[19],紫堇属成分具有抗病毒作用[20]。研究表明,中药单体或复方可以通过调节机体免疫实现对BVDV的抑制[21]。然而,目前国内对抗BVDV的中药研究基本停留在细胞水平上。另外,由于中药制剂成分繁多,药理作用复杂,作用靶点众多,抗病毒的分子机制仍难以明确[22-23]。本研究发现单一使用青蒿素具有抗BVDV复制的作用,若联合用药可能更好抑制BVDV的复制,但需要结合体内试验进行综合评价,中药单体或复方抗BVDV的分子机制仍是需要解决的科学问题。
本研究利用分子对接技术初步确定了青蒿素与BVDV-NS5B的互作关系,并发现BVDV感染MDBK细胞后给予100 μmol/L的青蒿素作用48 h,其对BVDV复制的抑制作用最强,为抗BVDV药物开发提供了新思路。
猜你喜欢 存活率青蒿素抗病毒 艾滋病抗病毒治疗中开展临床药学服务的作用探讨中国药学药品知识仓库(2022年2期)2022-03-23日本癌症10年平均存活率为57.2%,胰腺癌最低仅5.3%祝您健康(2020年5期)2020-05-14中国骄傲,一起致敬!作文评点报·作文素材初中版(2019年37期)2019-11-16“青蒿素抗药性”如何应对?屠呦呦等提出合理方案科学导报(2019年28期)2019-09-03大三阳但肝功正常需要抗病毒吗家庭医药(2017年9期)2017-09-14青蒿之内还有宝藏发明与创新·大科技(2016年10期)2016-10-22“中国神药”青蒿素治疟还治癌恋爱婚姻家庭·养生版(2016年1期)2016-01-07乙肝抗病毒治疗中的几大误区家庭医学(2015年6期)2015-07-03植物栽培温室大棚养殖林蛙试验河北渔业(2015年1期)2015-01-19温度对克氏原螯虾苗种生长和存活的影响河北渔业(2015年1期)2015-01-19
